
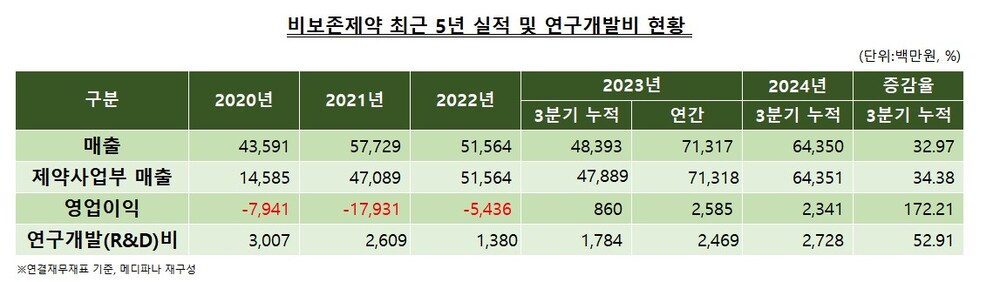
12일 비보존제약 분기보고서에 따르면, 회사는 연결기준 올해 3분기 누적 R&D 비용으로 27억원을 사용했다. 이는 지난해 같은 기간 R&D 비용인 18억원보다 52.9% 상승한 것으로, 투자 확대 기조를 이어가고 있다.
비보존제약은 최근 3년 간 R&D 비용을 꾸준히 늘려왔다. 지난해 25억원, 올해 3분기까진 27억원 이상을 투입하며 신약 개발 투자에 박차를 가하고 있는 모습이다. 이는 회사가 수익성 개선을 이루면서 투자 여력을 확보한 데 따른 것으로 풀이된다. 2020년에는 R&D비에 30억원을 투자하기도 했다.
제약사업부 매출도 꾸준히 증가하고 있어 회사는 오피란제린 승인을 비롯한 추가적인 의약품 투자에 적극적으로 나서고 있다. 제약사업부 매출은 2020년 146억원에서 지난해 713억원까지 급성장했다. 올해도 3분기 누적 644억원으로 전년 동기 대비 34.4% 증가한 것으로 나타났다.
다만 아직까지 매출 대비 R&D비가 차지하는 비율은 높지 않은 편이다. 2022년 2.7%, 지난해 3.5%, 올해 3분기까지 4.2%를 기록하며 점차 확대해 나가고 있는 추세다.
비보존제약 관계자는 "허가 심사기한이 정해져 있는 것은 아니지만, 일반적인 기간을 고려했을 때 이달 중에 결과가 나올 것으로 기대하고 있는 상황"이라고 전했다.
이와 함께 오피란제린 외용제(경피투여제제) 개발에 집중 투자하고 있다. 현재 식약처에 품목허가를 요청한 의약품은 주사제이며 이를 외용제 등 다양한 제형으로 개발하고 있는 것이다.
오피란제린은 최초로 개발한 다중 수용체 표적 비마약성 진통제로, 경피투여 제제를 개발하면 복약 순응도를 개선하고 비외과적 치료가 필요한 통증 환자까지 공급 확대가 가능할 것으로 예상된다.
외용제 개발은 국내에서 임상 2상까지 완료한 상태다. 회사는 내년 3상에 진입한다는 계획이다. 회사에 따르면 국내 2상의 경우 안전성 검증을 우선시해 진통 효능은 탐색적인 수준에서 확인했다.
또한 회사는 제형 개선에 대한 필요성과 사용 편의성 등을 논의해 새로운 크림 제형으로 개발을 고려하고 있는 상황이다. 관련 검토를 마치고 3상을 신청한다는 계획이다.
더불어 오피란제린에 대한 해외 품목허가 신청도 고려하고 있다. 국내에서 주사제 품목허가를 받으면 미국 등 해외에서 추가 임상시험을 진행해 글로벌 진출을 목표로 하고 있다.
업계에 따르면 해외에서 수술 후 진통제 전문의약품 시장 규모는 올해 기준 298억 달러(약 43조원), 4년 후인 2028년 기준으로는 351억 달러(약 50조원)가 예상된다. 통증 외용제 시장 규모는 올해 기준 130억 달러(약 18조 7000억원)로 매년 7.4% 성장률이 전망된다.
한편, 비보존제약의 연결기준 3분기 누적 매출액과 영업이익은 644억원, 23억원으로 집계됐다. 각각 전년 동기 대비 33%, 172% 증가한 수치다. 영업이익은 지난해 흑자 전환에 성공한 이후 올해 큰 폭의 성장세를 보이고 있다.

