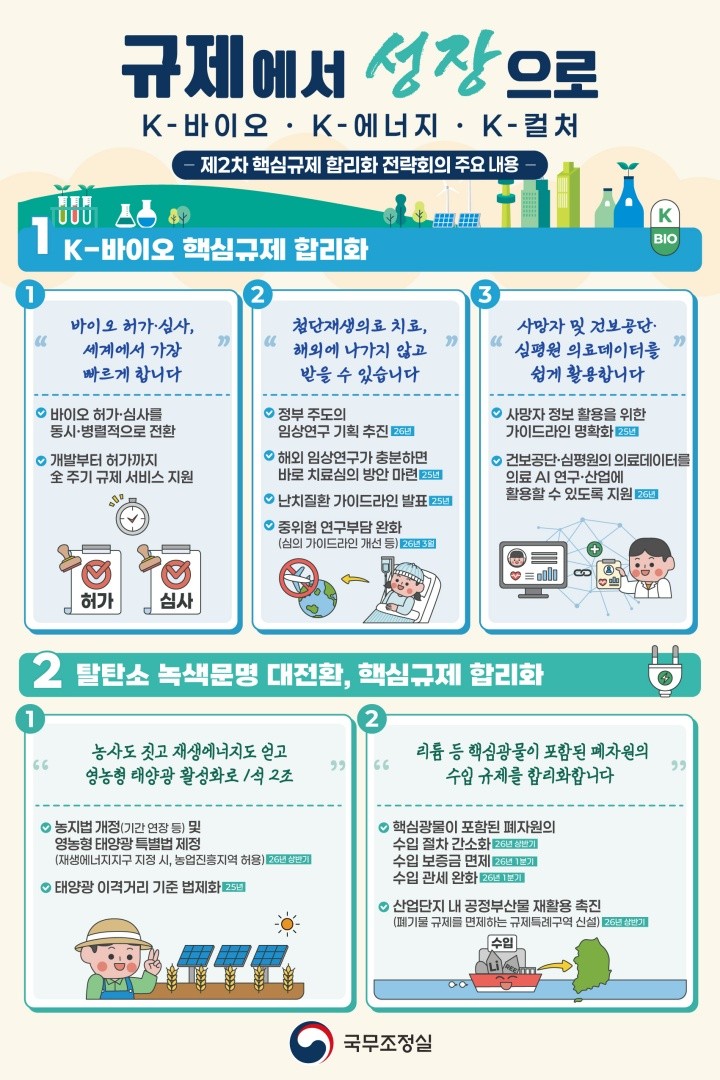
식품의약품안전처가 신약 허가 기간을 240일로 단축할 계획이다. 허가 심사 프로세스를 혁신하고 의약품 연구개발(R&D) 전 주기 규제를 지원해 안전한 치료제를 빠르게 보급하도록 돕기 위해서다.
16일 '제2차 핵심규제 합리화 전략회의'가 이재명 대통령 주재로 용산 대통령실에서 열렸다. 관계부처 장관, 기업·현장 관계자, 민간 전문가 등 40여 명이 이번 회의에 참석했다.
정부 자료에 따르면, 이번 회의는 지난달 개최한 '제1차 핵심규제 합리화 전략회의'에 이어 신산업 성장을 촉진하고, 국내 기업이 글로벌 시장에서 산업 패권을 쥘 수 있도록 규제를 합리화하자는 의지를 반영했다.
또한 정부는 규제기관이 아니라 국내 기업을 지원하고 육성하는 기관으로 거듭나고, 현장에서 나오는 목소리를 반영해 핵심 규제를 선제적으로 개선하고자 이번 회의를 마련했다.
특히 식약처는 이번 회의에서 허가·심사 프로세스 혁신을 통해 동시·병렬적 심사로 전환하고, 개발부터 허가까지 전 주기에 걸친 규제 서비스를 제공하겠다고 밝혔다.
그러면서 안전하고 효과적인 혁신 신약을 240일 내 허가해 국민이 치료받을 수 있는 기회를 확대하기 위해 노력할 계획이라고 강조했다.
식약처가 언급한 의약품 R&D 전 주기에 걸친 규제 서비스는 연구개발 단계에서 규제 정합성을 검토하고 비임상과 임상 단계에서 사전상담을 제공하는 걸 포함한다.
아울러 식약처는 기업이 의약품 허가를 신청하기 전에 사전에 검토하고, 본심사 단계에서 허가 관련 자료 등 보완을 위한 회의와 대면 상담을 진행한다.
이날 이재명 대통령은 급변하는 사회·환경 변화에 신속하고 유연하게 대처하기 위해 행정편의주의적 접근을 지양하고, 원칙적으로 허용하는 네거티브 방식으로 전환을 지속 추진할 것을 강조했다.
또한 민생과 산업 현장 변화 체감를 위해 전 부처 차원에서 규제합리화 과제를 지속 발굴하고, 개선방안을 신속히 발표해 나갈 것을 당부했다.
정부는 국무조정실을 중심으로 이번 회의에서 논의한 내용에 대한 후속조치를 구체화하고, 신속히 추진할 수 있도록 점검해 나갈 예정이다.

