
보건복지부는 30일 8시에 '2023년 제9차 건강보험정책심의위원회'를 개최하고, '약제 급여적정성 재평가 추진계획' 등에 대해 논의했다.
이에 따라 '2024년 약제 급여적정성 재평가' 대상 성분은 총 7개 성분으로 선정됐다.
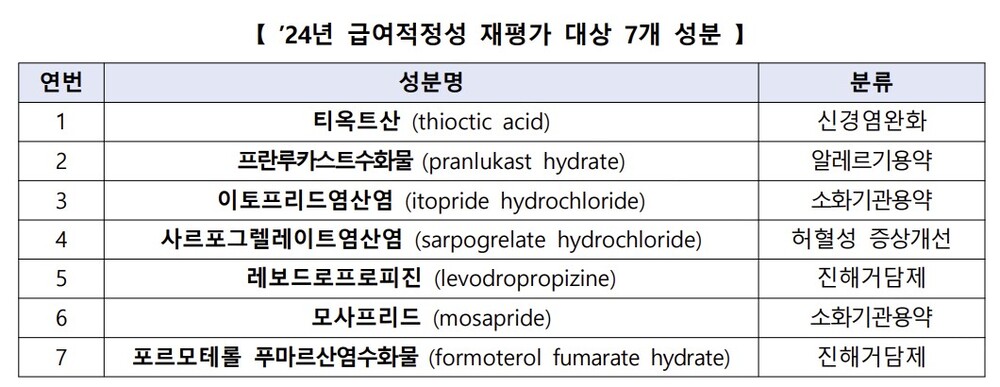
해당 성분들은 선정기준 및 전문가 자문 등을 통해 1998년부터 2001년 사이에 등재된 성분이자, 식약처에서 임상재평가 중인 성분으로써 임상적 유용성 등에 대한 재검토 필요성이 제기된 바 있다.
이와 함께 복지부는 약제 급여적정성 재평가 제도를 합리적이고 실효성 있게 운영하기 위해, 연구용역 결과 등을 바탕으로 세부적인 평가방법을 개선한다.
우선 임상적 유용성 관련 용어가 명확화된다. '1차 평가(교과서, 임상진료지침, HTA 보고서)'는 '의학적 권고'로, '2차 평가(임상연구문헌)'는 '임상효과성'으로 한다.
또 평가의 합리성을 제고하기 위해 의학적 권고 평가 시 문헌의 질적 수준을 종합적으로 고려토록 했다.
사회적 요구도를 평가함에 있어 평가요소를 의료적·사회적·재정적 요소로 구체화했고, 세부 내용을 정하고 평가위원회를 구성해 점수 방식으로 평가토록 함으로써 평가의 객관성을 도모했다.
한편, 급여 적정성 재평가는 보험 약제 사후관리의 일환으로, 건강보험 약제비 지출을 효율화하기 위해 2020년부터 추진됐다.
재평가 대상 품목 선정 기준은 ▲청구현황 ▲제외국(A8)' 허가 및 급여현황 ▲정책적·사회적 요구도 ▲기타 약제급여평가위원회가 필요하다고 인정하는 경우 등이다.
2020년 '콜린알포세레이트' 1개 성분을 시작으로, 2021년에는 건강기능식품과 혼용되는 4개 성분, 2022년에는 등재연도가 오래된('89~91년)' 6개 성분에 대해서 평가를 완료했다.
올해에는 1993년부터 1997년에 등재된 8개 성분 약제에 대한 급여적정성 평가가 진행 중이다.

