8일 미국 식품의약국(FDA)은 최근 BCMA 표적 CAR(키메라항원수용체)-T 세포 치료제인 J&J '카빅티(실타캅타진 오토류셀)'와 BMS '아베크마(이데캅타진 비클류셀)'를 재발 또는 불응성 다발골수종 각각 2, 3차 치료제로 승인했다.
이번 확대 승인은 개인 맞춤형 CAR-T 세포 치료제를 다발골수종 초기 치료에도 받을 수 있다는 점에서 의미가 깊다.
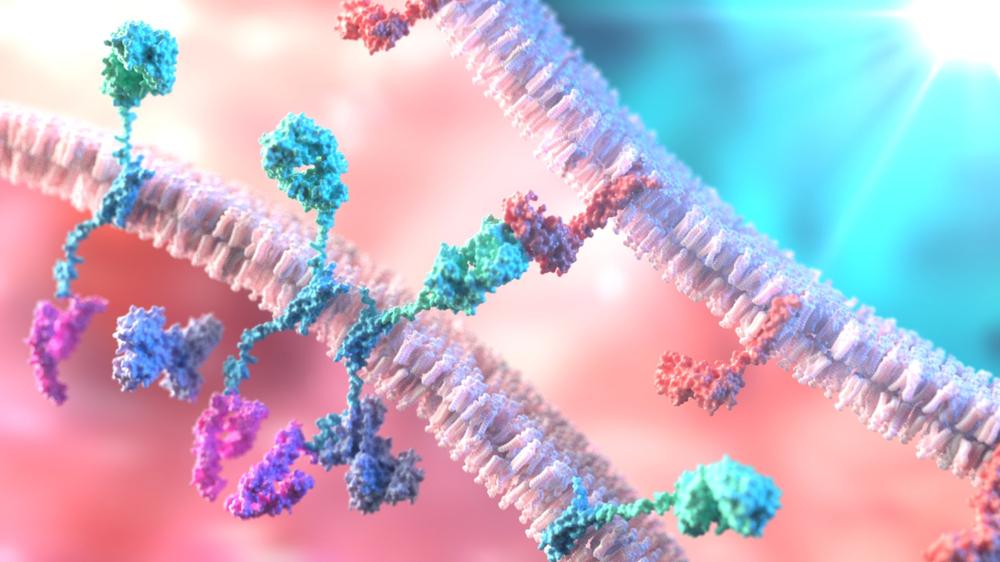
카빅티나 아베크마는 다발골수종 세포 표면의 BCMA를 인식하고 결합해 CAR-T 세포를 증식, 사이토카인 분비, BCMA 발현 세포의 세포 용해 사멸을 유도하는 기전의 치료제다.
이 치료제들은 지난 2021년부터 미국에서 이전에 4가지 치료를 받은 재발 또는 불응성 다발골수종 성인 환자의 치료제로 처음 승인됐다.
아베크마도 1차 평가변수인 무진행 생존기간(PFS)을 표준요법(PVd+DPd)에 비해 질병 진행 또는 사망 위험을 51% 감소시킨 것으로 분석됐다. 무진행 생존기간 중앙값은 아베크마 치료군이 13.3개월, 표준 요법군이 4.4개월이었다.
또한 아베크마로 치료받은 환자 반응률은 71%였고, 49%는 완전 관해에 이르렀다. 이에 비해 표준요법군의 전체 반응률은 42%였고, 완전 관해 또는 엄격한 완전 관해에 도달한 환자 비율은 5%였다.
안전성 프로파일에서도 카빅티와 아베크마는 기존 보고된 사이토카인 방출 증후군(CRS)과 저등급의 신경독성이 나타났다.
한편 다발골수종은 골수에서 면역체계를 담당하는 백혈구의 한 종류인 형질세포(Plasma Cell)가 비정상적으로 분화, 증식해 발생하는 혈액암이다.
다발성골수종의 재발률(80%)은 타 혈액암보다 높아 완치가 어렵고, 여기에 기존 치료제에 대한 불응성까지 높아 관해 유지기간이 점차 짧아지는 것이 특징이다.
여기에 CAR-T 세포 치료제는 환자에서 채취한 T세포 표면에 암세포의 특정 항원을 인지하는 키메릭 항원 수용체(CAR)가 발현될 수 있도록 유전적으로 재조합시킨 후 다시 환자의 몸에 주입하는 방식으로 이뤄진다.
세포·유전자·면역치료제의 특성을 모두 갖춰 단 1회 치료로 다른 치료 옵션이 없는 말기 혈액암 환자들을 완전 관해에 이르게 하고, 지속적인 반응을 보인다.

