[메디파나뉴스 = 최성훈 기자] 천연물 위염 치료제인 애엽추출물 제제에 대한 제약사들의 품목허가 취소 사례가 줄을 잇고 있다. 올해 급여적정성 재평가 및 의약품동등성 재평가가 동시에 이뤄지면서 제약사들이 품목 유지에 부담을 느낀 것으로 평가된다.
이러한 시장 철수 움직임은 곧 있을 약제 급여적정성 재평가 결과에 따라서 더욱 가속화될 것으로 보인다.
4일 식품의약품안전처 품목허가현황 등에 따르면 최근 1년 반 동안 애엽추출물 제제 품목허가 취소 사례는 총 66건이었다.
급여목록에 오른 105개사 142개 품목 중 46.4%로, 절반에 조금 못 미치는 애엽추출물 제제가 사라진 셈이다.
보건복지부는 작년 2월 건강보험정책심의위원회에서 애엽추출물 제제를 2025년 약제 급여적정성 재평가 대상으로 선정하는 안건을 의결한 바 있다.
연간 청구액이 약 200억원 이상이면서 등재연도((2002~2005년)가 오래된 약제의 경우 급여적정성을 재평가하고 있다. 애엽추출물은 2005년 처음 등재됐는데, 최근 3년 평균 청구금액은 1215억원이다.
여기에 애엽추출물 제제 제네릭은 의약품동등성 재평가라는 허들도 넘어야 하는 상황이다. 식약처는 작년 12월 한약(생약)제제 전문의약품에 대한 의약품동등성 재평가 실시 공고를 냈다.
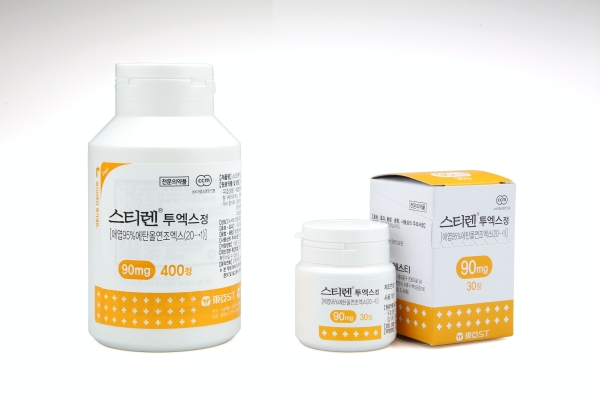
재평가 대상으로 분류된 품목은 애엽추출물 제네릭 제제 135개다. 이들 품목을 보유한 제약사는 지난달까지 오리지널 약인 동아에스티 '스티렌'과 대원제약 '오티렌' 대비 비열등성을 입증하는 시험 결과보고서를 제출토록 했다.
제약사로선 이 두 가지 허들 모두 부담이 됐을 가능성이 크다. 애엽추출물 제제의 약가인하나 퇴출 우려, 동등성 재평가에 따른 임상시험 비용 부담 등 '득보다 실'이 커질 수가 있다.
따라서 제약사들의 애엽추출물 허가 취소 사례는 더욱 가속화 될 수도 있다. 늦어도 내달이나 9월 중으로 '건강보험약제 급여적정성 재평가' 심의 결과가 공개되기 때문이다.
급여적정성 재평가는 건강보험심사평가원 약제급여평가위원회가 심사하는데 ▲임상적 유용성 ▲비용 효과성 ▲사회적 요구도 등을 놓고 평가한다.
'급여적정성 있음'으로 결론이 나면 1200억원대 시장은 유지 되겠지만, 문제는 '급여적정성 없음'으로 결론이 날 때다. 그렇게 될 경우 업계는 작년처럼 즉각 이의신청에 나설 것으로 보인다.
앞서 작년 7월 급여적정성 재평가 결과에선 '사르포그렐레이트염산염' 및 '레보드로프로피진'이 급여적정성 없음 판정을 받았다. 그러자 해당 품목을 보유한 제약사들은 즉각 이의를 제기한 바 있다.
사르포그렐레이트염산염의 연간 청구액은 약 1100억원, 레보드로프로피진은 약 320억원으로 두 품목 시장 규모가 적잖았기 때문이다.
이에 10월 재심의 결과에선 제약사 약가인하를 하는 조건으로 두 성분 모두 급여유지 판정을 받았다.
한편 애엽추출물 제제는 천연물 의약품 위염치료제로, 2002년 12월 동아에스티가 처음 출시했다. 급·만성 위염으로 인한 위점막 병변 개선 등에 적응증을 가지고 있다.

