빅시오스는 아일랜드에 본사를 둔 글로벌 바이오 제약회사 재즈 파마슈티컬이 개발한 신약이다. 한독이 국내 독점 판매 권한을 보유하고 있다.
건강보험심사평가원은 8일 제8차 약평위를 개최하고, 결정신청 약제의 요양급여 적정성 심의결과를 공개했다.
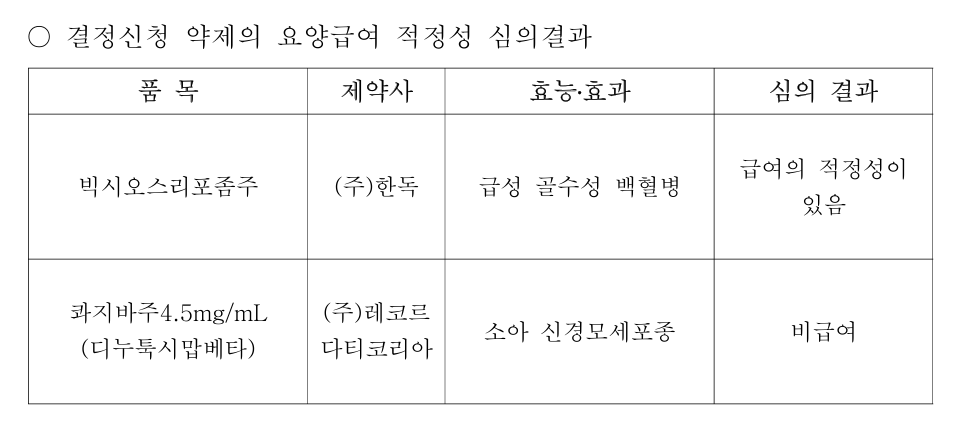
이 약물은 새로 진단받은 치료 관련 급성 골수성 백혈병(t-AML) 또는 골수이형성증 관련 변화를 동반하는 급성 골수성 백혈병(AML-MRC) 환자 치료로 쓰이고 있다.
빅시오스는 다우노루비신(daunorubicin)과 시타라빈(cytarabine)을 1:5 몰비(molar ratio)로 혼합한 리포좀 제형이다.
골수에서 고농도로 머무르는 시간이 길고 정상세포보다 백혈병 세포에 선택적으로 흡수돼 항종양효과가 상승적으로 나타난다.
관련 3상 임상에서 t-AML 또는 AML-MRC 환자를 대상으로 빅시오스 투여군은 9.6개월의 전체 생존기간(OS) 중앙값을 보였다. 해당 질환 표준요법인 시타라빈과 다우노루비신 7:3 요법의 OS는 6개월이다.
반면 레코르다티코리아 소아 신경모세포종 치료제 '콰지바주(디누툭시맙베타)'는 비급여로 결론이 났다.
한편 심평원은 혁신신약 가치 보상 등을 통한 환자 접근성 제고와 관련된 약가 제도를 개선 하고자 약평위 논의를 거쳐 신약 등 협상대상 약제의 세부평가기준을 개정했다.
질병부담이 큰 중증난치 질환에 사용되는 약제까지 위험분담제 적용 대상을 확대하고, 추가 청구액 15억원 미만의 위험분담 약제에 대한 급여 확대 절차를 간소화하기로 했다.
또한 ICER 임계값 평가 소요 중 하나인 혁신성의 의미를 구체화 하고, 성과기반 환급형 위험분담 적용 약제의 임상성과 평가 절차(방법 및 제출 자료 등)를 명확히 해 신약의 적정 가치 반영을 위한 기준을 마련했다.

