글자크기 설정
기사의 본문 내용은 이 글자크기로 변경됩니다.
담도암 1차 치료제로 허가된 최초의 면역항암제라는 점에서 환자와 의료계의 기대가 컸던 약이다.
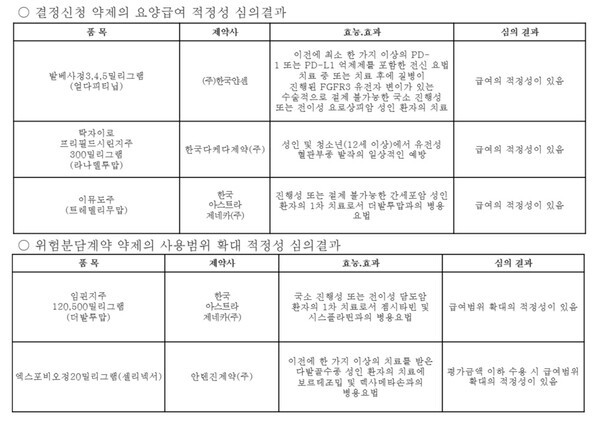
이와 더불어 간세포암 1차 치료에서 임핀지와 병용으로 사용되는 '이뮤도주(트렘엘리무맙)'도 급여 적정성을 인정받아 한국아스트라제네카는 염원을 이뤘다.
6일 건강보험심사평가원에 따르면, 결정신청 약제의 요양급여 적정성 심의에서 한국얀센의 '발베사정(얼다피티닙)' 3mg, 4mg, 5mg이 통과됐다.
발베사는 '이전에 최소 한 가지 이상의 PD-1 또는 PD-L1 억제제를 포함한 전신 요법 치료 중 또는 치료 후에 질병이 진행된 FGFR3 유전자 변이가 있는 수술적으로 절제 불가능한 국소 진행성 또는 전이성 요로상피암 성인 환자의 치료'에 급여를 신청했다.
2021년 2월 식품의약품안전처의 허가를 받은 한국다케다제약의 '탁자이로(라나델루맙)' 프리필드시린지주 300mg도 '성인 및 청소년(12세 이상)에서 유전성 혈관부종 발작의 일상적인 예방'에서 급여 적정성을 인정받았다.
이뮤도주는 지난해 11월 중증(암)질환심의위원회를 통과했지만, 9월 약평위 문턱은 넘지 못한 바 있다. 그러나 재도전 끝에 이번 약평위를 통과했다.
임핀지·이뮤도 병용요법은 '진행성 또는 절제 불가능한 간세포암 성인 환자의 1차 치료'에 사용된다. 현재 미국, 프랑스, 스위스, 독일, 이탈리아, 영국, 일본, 캐나다 등 주요 참조국 8개국과 대만 등에서도 급여가 적용되고 있다.
위험분담계약 약제의 사용범위 확대 적정성 심의에서는 한국아스트라제네카의 임핀지주 120mg, 500mg이 '국소 진행성 또는 전이성 담도암 환자의 1차 치료로서 젬시타빈 및 시스플라틴과의 병용요법'에 급여 범위가 확대됐다.
치료 선택지가 극히 제한적인 담도암에서 2022년 국내 허가를 받은 임핀지는 장기생존 데이터를 갖고 있음에도 급여 난관을 겪었다. 담도암은 지난 10년간 급여 신약이 한 건도 없었다는 점에서, 임핀지의 급여를 요청하는 목소리가 높았다.
다행히 이번 약평위 통과로 담도암도 글로벌 표준치료를 적용받을 수 있게 됐다.
반면 안텐진제약의 '엑스포비오정(셀리넥서)' 20mg은 '이전에 한 가지 이상의 치료를 받은 다발골수종 성인 환자의 치료에 보르테조밉 및 덱사메타손과의 병용요법'에 급여 확대를 꿈꿨지만, 평가금액 이하 수용 시 급여 범위 확대의 적정성이 있다고 판단됐다.
이 기사를 공유합니다
박으뜸 기자
acepark@medipana.com
관련기사

