이런 기사
어때요?
실시간
빠른뉴스
유한양행, '제2회 유한 이노베이션 프로그램 네트워킹 데이' 개최
유한양행(대표이사 조욱제)이 지난 17일 서울드래곤시티 호텔에서 '제2회 유한 이노베이션 프로그램(YIP) 네트워킹 데이' 행사를 진행했다. 이날 행사에는 유한양행 조욱제 대표이사와 김열홍 R&D 총괄사장을 비롯한 R&D 본부 임원, 연구원 및 YIP 연구자와 유한 관계사 등 약 100명이 참석해 YIP 과제의 연구결과 발표와 함께 후속 연구 방향에 대한 논의가 진행됐다. 유한양행은 2022년부터 혁신 신약 개발을 위한 기초연구 지원 프로그램인 '유한 이노베이션 프로그램(YIP)'을 운영하고 있다. 유한 이노베이션
전국의대 1만3천명, 증원중지 요청…재판부, 누구손 들까
[메디파나뉴스 = 김원정 기자] 내년도 의대 정원 증원결정이 아직 일단락되지 않고 있다. 전국 의과대생 1만3000여 명이 제기한 의대정원 증원 처분 집행정지 인용 결정을 앞두고 있어서다. 서울고등법원이 이번에는 지난 16일 판결과 달리 의대교수와 의대생 손을 들어줄지 주목된다. 이와 관련 20일 서울대학교 의과대학 의학과 김종일 교수 외 2만742명은 지난 16일 고법 결정문 '공공의 복리를 저하시킬 우려'에 대해 반박하는 이유를 밝힌 고찰보고서와 탄원서를 현재 고법에 계류 중인 충북대생을 포함한 전국 의대 재학생 1만3000명이
한국베링거인겔하임, '혁신을 통한 가치 창조 데이' 개최
한국베링거인겔하임(사장 아나마리아 보이)은 지난 16일, 임직원과 함께 베링거인겔하임의 기업 비전 및 핵심 가치를 되새기고, 실천 의지를 다지는 ‘혁신을 통한 가치 창조 데이(VTI Day)’를 진행했다고 20일 밝혔다. '혁신을 통한 가치 창조 데이'는 직원들과 함께 베링거인겔하임의 기업 비전인 '혁신을 통한 가치 창조(Value Through Innovation)'의 의미를 공유하고자 마련된 자리로 한국 및 아시아 태평양 지역의 베링거인겔하임 지사에서 동시에 진행하는 글로벌 행사다. 특히, 이번 행사는 직원
-
한국쿄와기린, 제21회 소아암환우돕기 마라톤대회 참가
한국쿄와기린(대표이사 타카아키 우오치)은 지난 19일 여의도 한강공원에서 개최된 제21회 소아암환우돕기 마라톤 대회에 참가했다고 20일 밝혔다. 지금은 종식된 코로나19로 인해 오프라인 대회는 중단되었다 작년에 재개, 올해는 지난 해보다 더 많은 임직원이 참가했다. 자
-
파브리병으로 인한 심장·신장 손상 막으려면 조기 치료 필수
올해 1월부터 신생아선별검사 항목 중 파브리병을 포함한 리소좀 축적질환 6종의 검사가 급여 항목으로 포함됐다. 이로써 앞으로 유전성 희귀질환인 파브리병의 신규 진단이 대폭 늘어날 것으로 예상되며, 조기 진단 및 치료에 대한 관심이 높아지고 있다. 파브리병은 세포 내 노
-
GC녹십자, 산필리포증후군 치료제 美 FDA IND 승인
GC녹십자(대표 허은철)는 노벨파마와 공동 개발중인 산필리포증후군 A형 치료제(MPS IIIA) ‘GC1130A’에 대한 임상 1상 임상시험계획서(IND)를 미국 식품의약국(FDA)으로부터 승인 받았다고 20일 밝혔다. 이번 승인으로 ‘
-
제약바이오협회, 내달부터 '해외 사업개발' 인력 양성 개시
한국제약바이오협회(회장 노연홍)는 산업계의 해외진출 역량 강화를 위해 '2024년도 상반기 해외 사업개발(GBD) 교육'을 마련, 오는 30일까지 교육생 모집에 나선다고 20일 밝혔다. 이는 국내 제약바이오업계 기술수출, 현지법인 설립 등 글로벌 진출 행보가 활발해지면
당신이
읽은분야
주요기사









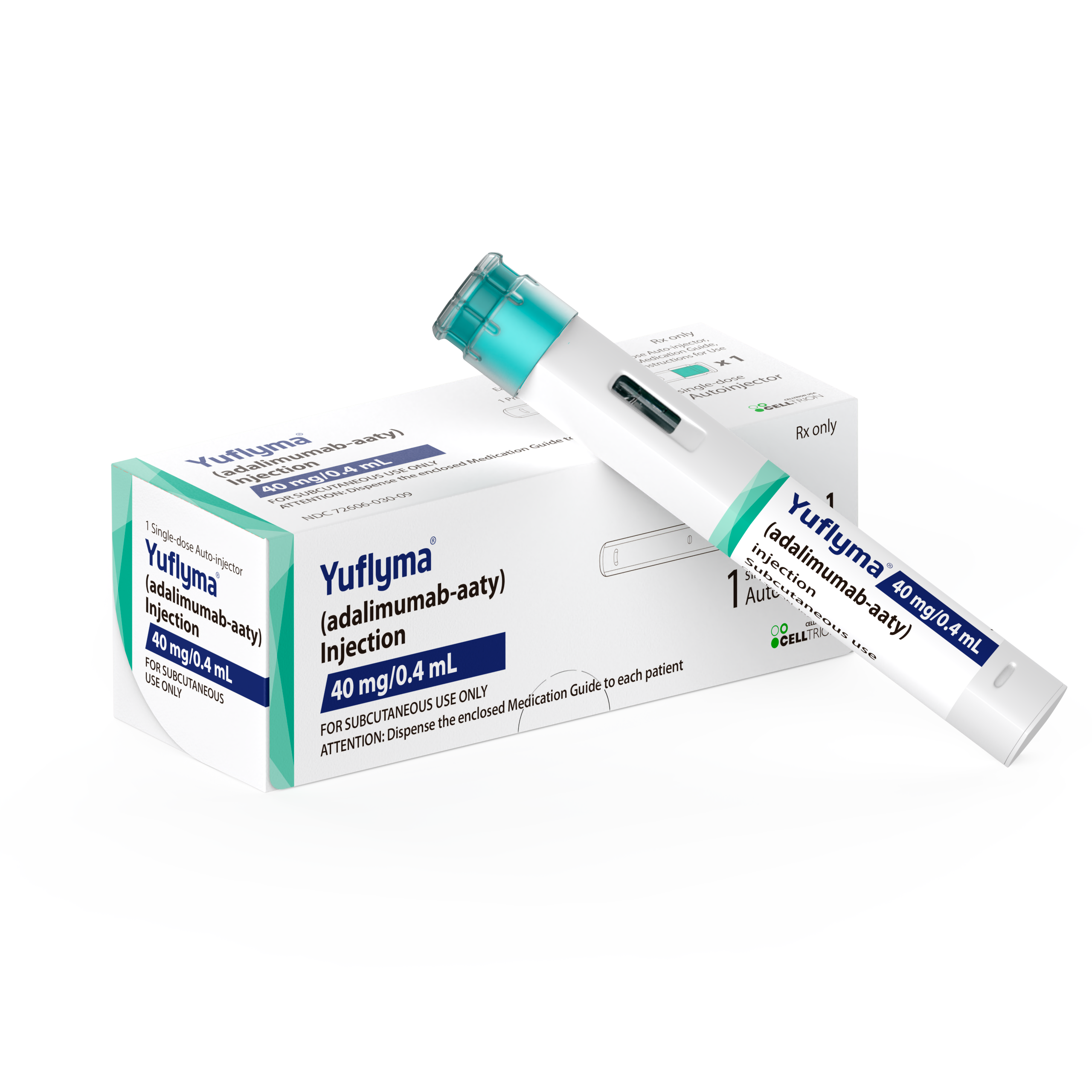
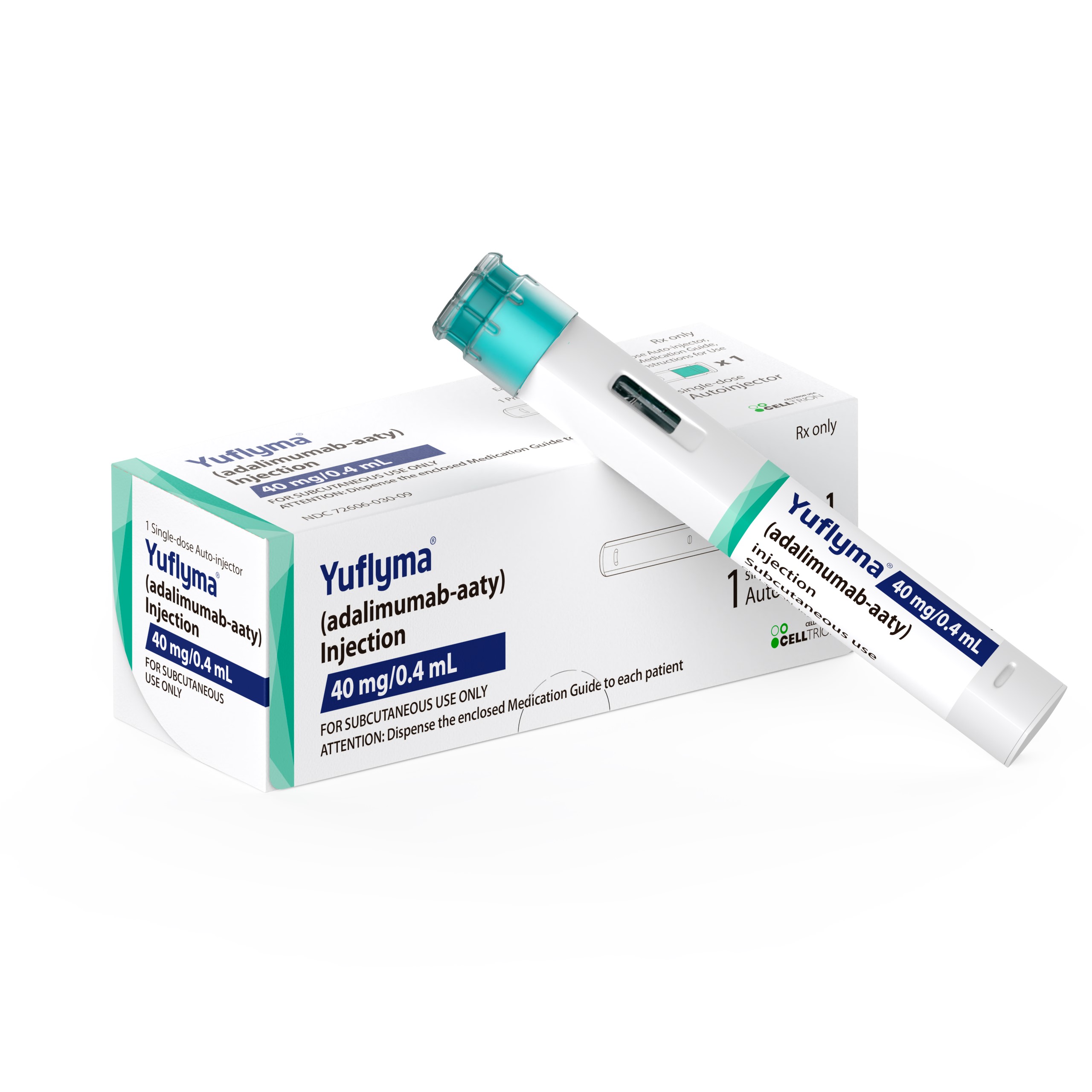
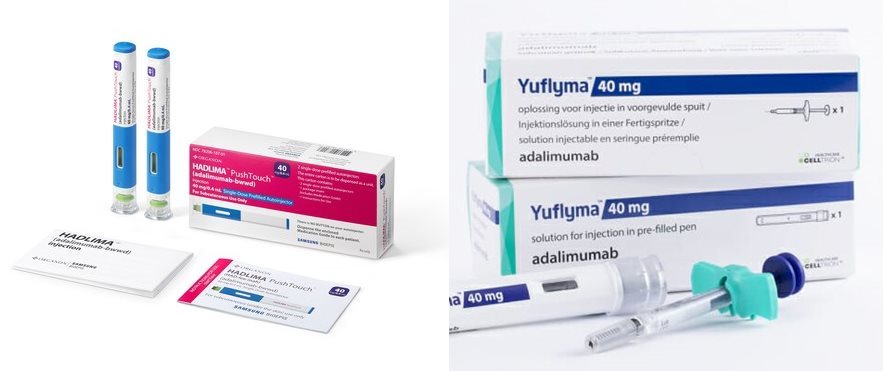







![[포토] '바이오 코리아 2024' 첫째날 현장 스케치](/upload/editor/20240508203457_ECB3E.jpg)

독자의견
작성자 비밀번호
0/200