мӢӨмӢңк°„
л№ лҘёлүҙмҠӨ
л°•мЈјлҜј көӯнҡҢмқҳмӣҗ, нҷҚлҰүнҸ¬лҹј л°©л¬ёвҖҰл°”мқҙмҳӨ R&D нҒҙлҹ¬мҠӨн„° л…јмқҳ
нҷҚлҰүнҸ¬лҹјмқҖ 26мқј л°•мЈјлҜј лҚ”л¶Ҳм–ҙлҜјмЈјлӢ№ көӯнҡҢмқҳмӣҗмқҙ л°©л¬ён•ҙ к°„лӢҙнҡҢлҘј к°ҖмЎҢлӢӨкі 27мқј л°қнҳ”лӢӨ. мқҙлӮ к°„лӢҙнҡҢм—җм„ң л¬ёкёёмЈј нҷҚлҰүнҸ¬лҹј мқҙмӮ¬мһҘмқҖ нҷҚлҰүмқҳ л№„м „кіј л°©н–Ҙмқ„ м„ӨлӘ…н–Ҳкі , к№Җнҳ„мҡ° м„јн„°мһҘмқҖ л°”мқҙмҳӨмӮ°м—…м—җм„ң м„ңмҡё, нҠ№нһҲ нҷҚлҰүмқҳ м—ӯн• м—җ лҢҖн•ҙ м„ӨлӘ…н–ҲлӢӨ. мқҙм—җ л”°лҘҙл©ҙ, нҷҚлҰүмқҖ л°•мӮ¬кёү мқёмһ¬ 7000лӘ…, лҢҖн•ҷмғқ м•Ҫ 12л§ҢлӘ…, н•ңкөӯкіјн•ҷкё°мҲ м—°кө¬мӣҗмқ„ 비лЎҜн•ң 4к°ң көӯмұ… м—°кө¬кё°кҙҖ, 4к°ң лҢҖн•ҷлі‘мӣҗ, м„ңмҡёл°”мқҙмҳӨн—ҲлёҢ л“ұмқ„ к°–м¶”кі мһҲлӢӨ. к№Җнҳ„мҡ° м„јн„°мһҘмқҖ нҷҚлҰүмқҙ R&D мӨ‘мӢ¬мқҳ л°”мқҙмҳӨ нҒҙлҹ¬мҠӨн„°лЎңм„ң мҶЎлҸ„лӮҳ мҳӨмҶЎкіј м°Ёлі„нҷ”лҗң к°•м җмқ„ к°–кі мһҲмқҢмқ„ к°•мЎ°н–ҲлӢӨ. нҷҚлҰүмқҙ лҸ„мӢңмһ¬мғқ
[м ңм•ҪкіөмӢң мұ…к°Ҳн”ј] 9мӣ” 4мЈјм°Ё - м…ҖнҠёлҰ¬мҳЁВ·лӘ…мқём ңм•ҪВ·лҸҷм„ұм ңм•Ҫ еӨ–
[л©”л””нҢҢлӮҳлүҙмҠӨ = мқҙм •мҲҳ кё°мһҗ] 2025л…„ 9мӣ” 4мЈјм°Ё(9.22~9.26)м—җлҠ” м…ҖнҠёлҰ¬мҳЁмқҙ лӢӨкөӯм Ғм ңм•ҪмӮ¬ мқјлқјмқҙ лҰҙлҰ¬ мһҗнҡҢмӮ¬к°Җ мҡҙмҳҒн•ҳлҠ” мқҳм•Ҫн’Ҳ м ңмЎ°м—…мІҙлҘј 4600м–өмӣҗм—җ мқёмҲҳнӮӨлЎң н–ҲлӢӨ. м§ҖлӮң 7мӣ” мҳҲкі м—җ мқҙм–ҙ 2лӢ¬ л§Ңм—җ лӮё м„ұкіјлӢӨ. нҡҢмӮ¬лҠ” мқҙлІҲ м—…мІҙ мқёмҲҳлЎң лҜёкөӯн–Ҙ мҲҳм¶ң мқҳм•Ҫн’Ҳ кҙҖм„ё лҰ¬мҠӨнҒ¬ н•ҙмҶҢлҘј кё°лҢҖн•ҳкі мһҲлӢӨ. лӢЁмҲңнһҲ лҜёкөӯ нҳ„м§Җм—җ мғқмӮ°мІҙкі„лҘј кө¬м¶•н•ң кІғм—җ к·ём№ҳм§Җ м•Ҡкі , кіөмһҘ мҰқм„Өкіј R&D кё°лҠҘ к°•нҷ”лЎң кіөмһҘ м—ӯн• мқ„ лҶ’мқј мҳҲм •мқҙлӢӨ. лӘ…мқём ңм•Ҫмқҙ 10мӣ” 1мқј мҪ”мҠӨн”ј мғҒмһҘмқ„ лҲҲм•һм—җ л‘җкі мһҲлӢӨ. мҪ”мҠӨн”ј мғҒмһҘмқ„ мң„н•ң кё°м—…кіөк°ң кіөлӘЁлЎң мөңлҢҖмЈјмЈј мқҙ
'м„ұ분лӘ… мІҳл°© к°•м ң' лІ•м•ҲвҖҘмқҳлЈҢкі„ л°ҳл°ң, к¶җкё°лҢҖнҡҢлЎң л¶Ҳм”Ё нҷ•мӮ°
[л©”л””нҢҢлӮҳлүҙмҠӨ = л°•мңјлңё кё°мһҗ] м„ұ분лӘ… мІҳл°©мқ„ л‘ҳлҹ¬мӢј к°Ҳл“ұмқҙ лӢӨмӢң мҲҳл©ҙ мң„лЎң л– мҳ¬лһҗлӢӨ. 2000л…„ мқҳм•Ҫ분업 лҸ„мһ… мқҙнӣ„ 20м—¬ л…„к°„ мқҙм–ҙм ё мҳЁ л…јмҹҒмқҖ көӯнҡҢ лІ•м•Ҳ л°ңмқҳлҘј кі„кё°лЎң лӢӨмӢң м җнҷ”лҗҗкі , 26мқј м„ңмҡёмӢңмқҳмӮ¬нҡҢк°Җ 'м„ұ분лӘ… мІҳл°© л°ҳлҢҖ к¶җкё°лҢҖнҡҢ'лҘј м—ҙл©ҙм„ң л¶Ҳм”ЁлҠ” лҚ”мҡұ м»ӨмЎҢлӢӨ. мқҳлЈҢкі„мқҳ 집лӢЁн–үлҸҷмқҙ м „көӯмңјлЎң нҷ•мӮ°лҗ м§Җ, лҳҗ лӢӨлҘё 충лҸҢлЎң мқҙм–ҙм§Ҳм§Җ мЈјлӘ©лҗңлӢӨ. лҚ”л¶Ҳм–ҙлҜјмЈјлӢ№ мһҘмў…нғң мқҳмӣҗмқҙ лҢҖн‘ң л°ңмқҳн•ң мқҳлЈҢлІ•·м•ҪмӮ¬лІ• к°ңм •м•ҲмқҖ ліҙкұҙліөм§Җл¶Җ мһҘкҙҖмқҙ мҲҳкёүл¶Ҳм•Ҳм • мқҳм•Ҫн’Ҳмқ„ м§Җм •н•ҳл©ҙ, мқҳмӮ¬мҷҖ м№ҳкіјмқҳмӮ¬к°Җ н•ҙлӢ№ мқҳм•Ҫн’Ҳмқ„ мІҳл°©н• л•Ң мғҒн’ҲлӘ…мқҙ м•„лӢҢ м„ұ분лӘ…мқ„
-
"SGLT-2i, лӢЁмқјліҙлӢӨ лі‘мҡ©м—җм„ң к°Җм№ҳ м»Ө"вҖҰнҷҳмһҗ л§һм¶ӨмЎ°н•© мЎ°лӘ…
[л©”л””нҢҢлӮҳлүҙмҠӨ = мөңмқёнҷҳ кё°мһҗ] "SGLT-2 м–өм ңм ңлҠ” лӢЁмқј м•Ҫм ңлҘј л„ҳм–ҙ лі‘мҡ© мҡ”лІ•м—җм„ң лҚ” нҒ° к°ҖлҠҘм„ұмқ„ ліҙм—¬мӨҖлӢӨ." лӢ№лҮЁлі‘ м№ҳлЈҢм—җм„ң SGLT-2 м–өм ңм ңлҘј 축мңјлЎң н•ң лі‘мҡ© мҡ”лІ•мқҳ мһ„мғҒм Ғ к°Җм№ҳк°Җ 집мӨ‘ мЎ°лӘ…лҗҗлӢӨ. м—°мһҗл“ӨмқҖ м•Ҫм ңлі„ нҠ№м„ұкіј нҷҳмһҗкө°лі„ м°ЁмқҙлҘј кі л Өн•ң л§һм¶Өнҳ• мЎ°н•©мқҙ
-
"нқ¬к·ҖВ·мӨ‘мҰқм§Ҳнҷҳ м№ҳлЈҢм ң м ‘к·јм„ұ лҶ’мқҙкі вҖҰнҶөмғҒнҷҳкІҪ лҢҖ비н•ҙм•ј"
[л©”л””нҢҢлӮҳлүҙмҠӨ = к№Җмӣҗм • кё°мһҗ] нқ¬к·Җ·лӮңм№ҳ·мӨ‘мҰқм§Ҳнҷҳ нҷҳмһҗл“Өмқҳ м№ҳлЈҢнҷҳкІҪмқ„ к°ңм„ н•ҳкё° мң„н•ҙм„ңлҠ” м№ҳлЈҢм ң м ‘к·јм„ұмқ„ лҶ’мқј мҲҳ мһҲлҸ„лЎқ кұҙк°•ліҙн—ҳм—җ лҢҖн•ң кө¬мЎ°м Ғ н•ңкі„лҘј к°ңм„ н•ҳкі , мӮ¬нҡҢм Ғ м•Ҳм „л§қ кё°лҠҘмқ„ к°•нҷ”н•ҙм•ј н•ңлӢӨлҠ” м§Җм Ғмқҙ лӮҳмҷ”лӢӨ. м•„мҡёлҹ¬ 진лӢЁ м§Җм—°, м№ҳлЈҢм ң
-
мқҳлЈҢкі„ л“ұ м—…мқҖ мҠӨм№ҙмқҙлһ©мҠӨ, л°ҳм§Җнҳ• нҳҲм••кі„ мӢңмһҘ нҷ•мӮ° мұ„비
[л©”л””нҢҢлӮҳлүҙмҠӨ = мөңм„ұнӣҲ кё°мһҗ] м„ёкі„ мөңмҙҲлЎң л°ҳм§Җнҳ• нҳҲм••кі„лҘј мғҒмҡ©нҷ”н•ң мҠӨм№ҙмқҙлһ©мҠӨк°Җ ліёкІ©м Ғмқё м ңн’Ҳ нҷ•мӮ°м—җ лӮҳм„ лӢӨ. нҡҢмӮ¬к°Җ л°ҳм§Җнҳ• нҳҲм••кі„ м¶ңмӢң 1л…„ л§Ңм—җ мқҳлЈҢкё°кҙҖ мӨ‘мӢ¬мңјлЎң м ңн’Ҳ ліҙкёүм—җ м„ұкіөн•ң л§ҢнҒј, мқјл°ҳ кұҙк°• мӢңмһҘк№Ңм§Җ л…ёлҰ°лӢӨлҠ” к°ҒмҳӨлӢӨ. 26мқј кҙҖл Ём—…кі„м—җ л”°лҘҙл©ҙ мҠӨм№ҙмқҙлһ©мҠӨлҠ”
-
м•ҪмӮ¬нҡҢ мӢңлҸ„м§Җл¶ҖмһҘнҳ‘мқҳнҡҢ, м•ҪмӮ¬ нҳ„м•Ҳ мӨ‘м җ л…јмқҳ
м„ңмҡёнҠ№лі„мӢңм•ҪмӮ¬нҡҢ(нҡҢмһҘ к№Җмң„н•ҷ)мқҖ м§ҖлӮң 24мқј м„ңмҡём—ӯ мқёк·јм—җм„ң мӢңлҸ„м§Җл¶ҖмһҘнҳ‘мқҳнҡҢ(нҡҢмһҘ кі мҳҒмқј кІҪл¶Ғм•ҪмӮ¬нҡҢмһҘ)лҘј мЈјкҙҖн•ҳкі , ліҙкұҙмқҳлЈҢнҷҳкІҪ ліҖнҷ”м—җ л”°лҘё 비лҢҖл©ҙ진лЈҢ л“ұ м•ҪмӮ¬ нҳ„м•Ҳмқҳ лҢҖмІҳ л°©м•Ҳмқ„ л…јмқҳн–ҲлӢӨ. мқҙлӮ нҳ‘мқҳнҡҢм—җм„ңлҠ” м–‘м„ұмқј 분лӢ№м„ңмҡёлҢҖлі‘мӣҗ көҗмҲҳ(м „ ліҙкұҙліөм§Җл¶Җ м°ЁкҙҖ)лҘј мҙҲл№ҷн•ҙ '
лӢ№мӢ мқҙ
мқҪмқҖ분야
мЈјмҡ”кё°мӮ¬
 м№ҙм№ҙмҳӨмұ„л„җ추к°Җ
м№ҙм№ҙмҳӨмұ„л„җ추к°Җ



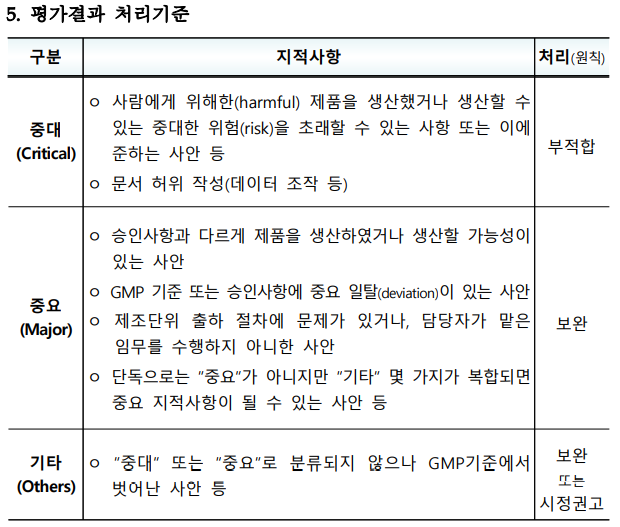
 [л©”л””нҢҢлӮҳлүҙмҠӨ = н—Ҳм„ұк·ң кё°мһҗ] мһ„мғҒмӢңн—ҳмҡ© мқҳм•Ҫн’Ҳ GMP нҸүк°Җк°Җ мң„н—ҳлҸ„ кё°л°ҳ мӢӨнғңмЎ°мӮ¬лЎң 추진 лҗЁм—җ л”°лқј к·ё ліҖнҷ”к°Җ к°Җмқҙл“ңлқјмқём—җлҸ„ л°ҳмҳҒлҗҗлӢӨ.
[л©”л””нҢҢлӮҳлүҙмҠӨ = н—Ҳм„ұк·ң кё°мһҗ] мһ„мғҒмӢңн—ҳмҡ© мқҳм•Ҫн’Ҳ GMP нҸүк°Җк°Җ мң„н—ҳлҸ„ кё°л°ҳ мӢӨнғңмЎ°мӮ¬лЎң 추진 лҗЁм—җ л”°лқј к·ё ліҖнҷ”к°Җ к°Җмқҙл“ңлқјмқём—җлҸ„ л°ҳмҳҒлҗҗлӢӨ.






![[нҸ¬нҶ ] лҸҢмһ”м№ҳліҙлӢӨ кё°л¶Җ, 충л¶ҒлҢҖлі‘мӣҗм—җ мІ«лҸҢ кё°л…җ м„ н–ү](/upload/editor/20250926100825_8B118.jpg)


лҸ…мһҗмқҳкІ¬
мһ‘м„ұмһҗ 비л°ҖлІҲнҳё
0/200