존슨앤드존슨의 제약부문 국내 법인인 한국얀센(대표이사 크리스찬 로드세스)은 지난 21일 자사의 이중작용 인터루킨-23(IL-23) 억제제 '트렘피어(구셀쿠맙)'가 중등도에서 중증의 활동성 크론병 및 궤양성 대장염 환자 중 기존 치료제(보편적인 치료제, 생물학적 치료제 또는 소분자제제)에 적절히 반응하지 않거나, 내약성이 없는 환자를 대상으로 식품의약품안전처의 허가를 받았다고 25일 밝혔다.
이번 승인으로 트렘피어는 2025년 8월 기준, 국내에서 궤양성 대장염과 크론병 두 질환에 대한 치료제로 허가받은 최초이자 유일한 IL-23억제제로 자리매김했다.
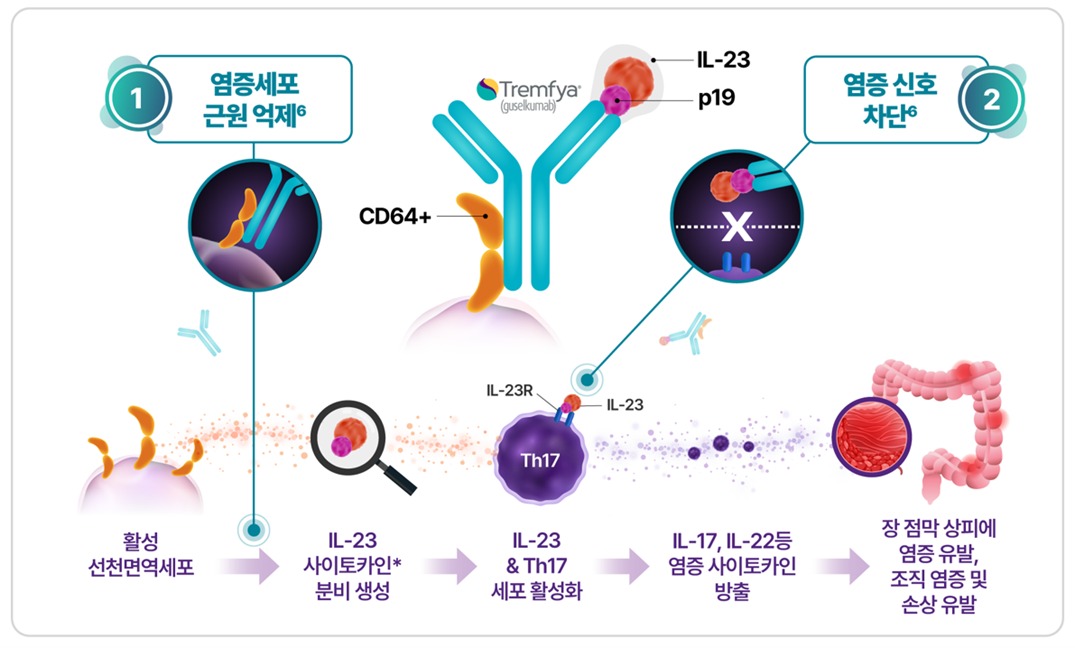
트렘피어는 염증 유도세포인 IL-23을 선택적으로 표적하는 완전 인간 유래 이중작용 단일클론 항체로, IL-23의 p19서브유닛에 결합해 염증 유발 신호를 차단하는 동시에, IL-23을 생성하는 CD64+ 면역세포에 직접 작용해 IL-23의 활성을 근원부터 억제하는 이중작용 기전을 보유한다.
이러한 이중작용 기전(dual-acting mechanism of action)은 염증의 '신호'와 '근원'을 동시 차단함으로써 차별화된 치료 효과를 기대할 수 있다. 크론병·궤양성 대장염 적응증의 허가 임상 연구를 통해서도 트렘피어는 임상적 관해를 넘어 깊은 관해(deep remission) 달성을 보이며 지속적인 효과 유지 및 환자들의 삶의 질 개선에 도움을 주는 것으로 나타났다.
트렘피어의 크론병 적응증은 중등도에서 중증의 활동성 크론병 환자를 대상으로 진행된 다기관∙다국적 이중맹검 임상시험인 GALAXI 2·3상 연구 결과를 기반으로 허가됐다. 해당 연구는 우스테키누맙과의 우월성 평가를 포함한 직접 비교 임상시험으로, 다양한 내시경 기반 주요 평가 지표에서 트렘피어는 우스테키투맙 대비 통계적으로 유의한 우월성을 입증했다.
1차 평가 변수인 12주차 임상 관해율(CDAI<150)에서 트렘피어는 각각 42%(Q4W), 41%(Q8W)를 기록하며 우스테키누맙(34%) 대비 유의한 개선 효과를 보였다.
48주차 기준 내시경 반응률은 트렘피어 200mg Q4W 투여군에서 53%, 100mg Q8W 투여군에서 48%로 나타났으며, 우스테키누맙 투여군(37%)대비 각각 16%(p<0.0001) 및 11%(p=0.0085) 높은 수치를 기록했다. 내시경 관해율 또한 트렘피어 투여군에서 각각37%(200mg, Q4W), 33%(100mg, Q8W)로, 우스테키누맙 투여군(25%) 대비 우수한 개선 효과를 확인했다.
특히 트렘피어는 임상적 관해와 내시경적 관해를 모두 충족하는 깊은 관해(deep remission)에서도 각각 34%(Q4W), 30%(Q8W)를 기록해, 우스테키누맙(22%) 대비 통계적으로 유의한 우월성을 입증했다. 이를 통해 트렘피어는 단기 증상 조절을 넘어 점막 회복에서도 임상적으로 의미있는 개선 효과를 확인했다.
안전성은 전체 이상반응, 중대한 이상반응, 치료 중단률 모두에서 우스테키누맙 및 위약군과 유사하거나 낮은 수준으로 나타나, 기존 승인된 적응증과 일관된 안전성 프로파일을 보였다.
트렘피어의 궤양성 대장염 적응증의 경우 QUASAR 3상 임상시험 결과를 기반으로 이뤄졌다. 해당 연구는 중등도에서 중증의 활동성 궤양성 대장염 환자를 대상으로 진행된 다국가·다기관 이중맹검 임상시험으로, 트렘피어는 위약 대비 내시경 관해율과 조직학적 호전율 모두에서 통계적으로 유의한 치료 효과를 입증했다.
12주차 기준 임상 관해율은 트렘피어 투여군에서 23%로, 위약군의 8% 대비 유의미하게 높은 결과를 나타냈다(p<0.0001). 또한 200mg Q4W 투여군에서 유지요법 기간인 44주차에는 약 50%의 임상적 관해율을 보였으며, 내시경 관해율(MES=0)은 34%을 기록해 장 점막의 가시적인 치유 효과를 입증했다.
조직학적 개선(Geboes ≤3.1)은 트렘피어 유지요법군에서 64%로 나타나, 위약군의 31% 대비 뚜렷한 차이를 보였다. 안전성 프로파일은 기존 적응증에서 보인 안전성과 일관된 프로파일을 보였다.
크리스찬 로드세스 한국얀센 대표이사는 "이번 트렘피어의 적응증 확대는 궤양성 대장염 및 크론병 치료에서 단순한 염증 억제를 넘어 내시경적 치유와 삶의 질 개선 등 더 높은 치료 목표를 가능케 한다는 점에서 의미가 있다"며 "존슨앤드존슨은 국내 환자들이 질환을 넘어 건강한 삶을 회복할 수 있도록 외부 파트너들과 긴밀히 협력해 새로운 치료 옵션의 접근성을 높이고, 염증성 장질환에서 견고한 치료 포트폴리오의 확장을 지속적으로 이어갈 예정"이라고 말했다.
한편, 최근 5년간(2020년~2024년) 국내에서 크론병 및 궤양성 대장염 환자는 꾸준히 증가 추세를 보였으며, 두 질환 모두 만성적으로 재발된다는 점에서 새로운 치료제에 대한 수요가 높다.
존슨앤드존슨은 지난 30여년간 염증성 장질환 환자들의 미충족 의료 수요 해소를 위해 '레미케이드(인플릭시맙)'과 '스텔라라(우스테키누맙)' 등 지속적으로 치료의 기준을 높이는 혁신적인 치료제를 공급해왔다. 트렘피어는 존슨앤드존슨의 염증성 장질환 포트폴리오의 가장 최신 치료 옵션으로서, 이번 허가를 통해 국내 염증성 장질환 치료의 진화를 이끄는 또 하나의 전환점이 될 것으로 기대된다.
 카카오채널추가
카카오채널추가












독자의견
작성자 비밀번호
0/200