[메디파나뉴스 = 최성훈 기자] 의료 인공지능(AI)기업 루닛이 최신 항암신약에 대한 치료 반응 예측 연구를 '2025 미국 임상종양학회(ASCO 2025)'에서 발표한다.
암종 불문 치료제로 진화 중인 항체약물접합체(ADC) 치료제 '엔허투'부터 '클라우딘18.2(CLDN18.2)' 표적 치료제 '빌로이'까지 관련 바이오마커의 발현율을 정량화하는 연구여서 주목된다.
바이오마커 발현율에 따라 환자 치료 반응을 더욱 정확히 예측할 수 있는 만큼, 항암제와 동반진단을 위한 도구로써 향후 활용될 가능성이 크다.
메디파나뉴스는 루닛이 ASCO 2025에서 발표하는 연구 성과 12건 중 주요 연구 3가지를 꼽아봤다. ASCO 2025 연구 초록은 우리나라 시간으로 22일 오전 6시부터 공개됐다.
◆
루닛 스코프 uIHC로 HER2 정밀 진단↑
가장 주목할 만한 연구는 HER2 양성 담도암 환자를 대상으로 한 '엔허투 효과 예측' 연구다.
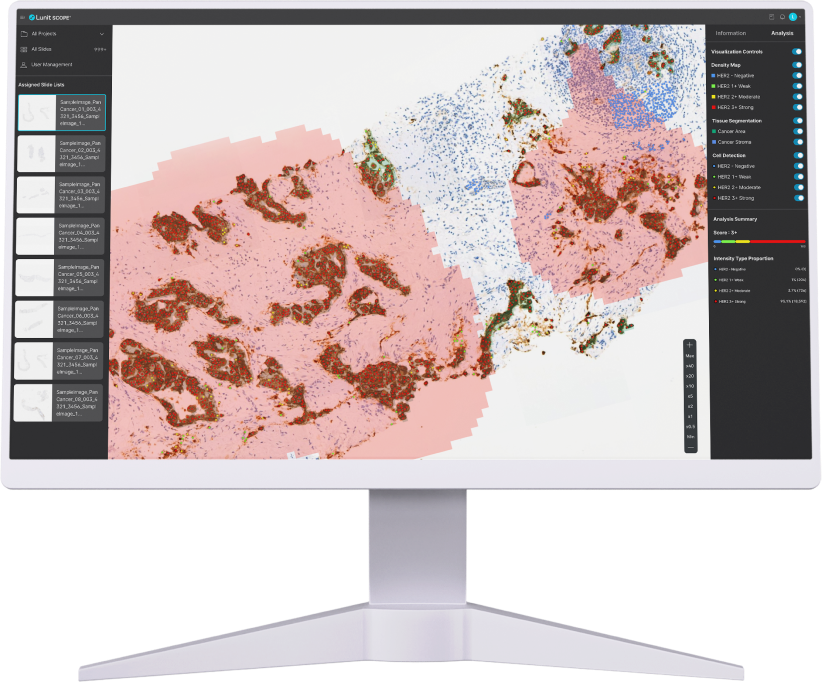
루닛은 HER2 양성 담도암 환자 288명의 면역조직화학(IHC) 슬라이드 이미지를 분석하는 과정에 루닛 스코프 유니버설 IHC(uIHC)를 적용, 암세포 HER2 발현 강도와 세포 내 위치(세포막, 세포질 등)에 따른 발현 분포를 정량 평가한 연구에서 엔허투 반응을 예측했다. 이 연구는 일본 국립암센터(이하 NCCE)와 공동으로 진행했다.
연구에 따르면 기존 HER2 평가 방법보다 루닛 스코프 uIHC를 통해 확인된 HER2 세포막 특이도가 높은(AI-H3+ ≥ 50%) 환자에서 치료 결과가 더욱 우수했다.
실제 엔허투 투약 환자 29명 중 HER2 세포막 특이도가 높은 환자들의 무진행 생존기간 중앙값(mPFS)은 11.0개월로, 세포막 특이도가 낮은 환자군의 4.2개월에 비해 통계적으로 유의했다.
반응률(ORR)에 있어서도 AI를 활용한 쪽이 더욱 우수했다. 루닛 스코프 uIHC를 통해 HER2 세포막 특이도가 높은 환자의 ORR은 50%이었던 반면, 세포막 특이도가 낮은 환자의 ORR은 28%였다.
이는 AI를 활용한 HER2 세포막 특이도 분석 방식이 기존 HER2 발현 강도 측정 방식보다 더 많은 엔허투 치료 반응 환자를 식별해낼 수 있음을 시사한다.
엔허투 사용에 더욱 적합한 환자들을 루닛 스코프 uIHC를 통해 찾을 수 있다는 의미다.
기존 HER2 평가 방법은 IHC 통해 HER2 발현율에 따라 초저발현(HER2 단백질 1% 미만)에서 양성(HER2 단백질 75% 이상)으로까지만 분류하고 있다.
◆
클라우딘18.2 발현 예측 AI 모델 연구 입증
진행성 위암 환자의 '클라우딘18.2(CLDN18.2)' 단백질 발현과 면역 표현형 예측에 관한 연구 결과도 이번 연구초록으로 채택됐다.
클라우딘18.2를 타겟으로 한 치료는 최근 위암 치료의 새 대안으로 떠오르고 있다. 바이오마커가 HER2 밖에 없던 위암에서 새 바이오마커인 클라우딘18.2을 표적하는 신약 ‘빌로이’가 출시되면서다.
HER2 음성 위암 환자 중 약 40%는 클라우딘18.2 단백질을 보유하고 있는 것으로 알려졌다.
루닛은 기본적인 H&E 슬라이드만으로 클라우딘18.2 발현을 예측하는 AI 모델을 개발했다. 459명의 위암 환자 데이터로 학습된 이 모델은 클라우딘18.2 양성 환자를 예측하는 성능이 독립된 검증 코호트에서 AUROC(성능평가지표) 값이 0.751으로 나타났다. AUROC 값은 1에 가까울수록 정확한 성능을 나타낸다.
이는 향후 H&E 슬라이드만 가지고도 클라우딘18.2 양성환자를 미리 선별할 수 있을 가능성을 보여준다.
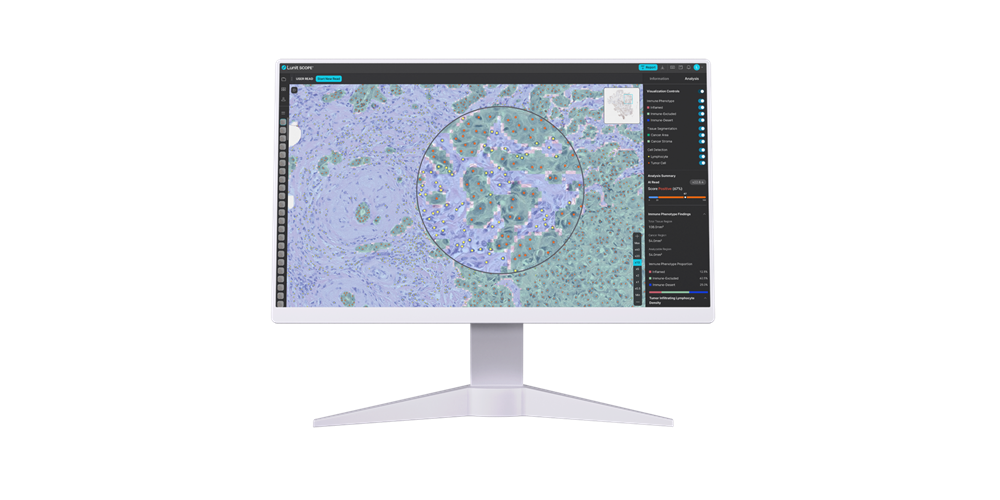
또한 클라우딘18.2 발현 여부는 면역관문 억제제 치료에 대한 반응과도 연관이 있어, 클라우딘18.2 음성이면서 면역 표현형이 면역활성(Inflamed)으로 밝혀진 환자군에서 면역 및 화학 병용요법으로 치료할 경우, 단독 화학요법 대비 무진행 생존기간(PFS)과 전체 생존기간(OS)이 유의하게 연장되는 것으로 나타났다.
AI로 예측한 클라우딘18.2 발현과 면역 표현형 정보가 위암 환자의 치료 결정을 돕는 유용한 도구가 될 것임을 시사하는 연구다.
◆
PD-L1 TPS서 전문의·AI간 진단율↑
폐암에서 병리과 전문의가 평가한 PD-L1 발현율(TPS)과 AI 기반 PD-L1 분석기의 성능을 비교·검증한 전향적 관찰연구도 이번 연구초록에 채택됐다.
PD-L1 발현율은 면역항암제 치료 효과를 예측하는데 있어 가장 유용한 바이오마커로, 루닛은 AI 기반 PD-L1 평가 모델 개발에 지속적인 연구·투자를 해왔다.
연구는 일본 국립암센터와 공동으로 비소세포폐암(NSCLC) 환자 847명과 소세포폐암(SCLC) 환자 102명을 대상으로, AI 기반의 루닛 스코프 PD-L1과 병리과 전문의 3명의 평가 결과를 비교 분석했다.
연구에 따르면 병리과 전문의 판독과 루닛 스코프 PD-L1은 폐암 환자의 PD-L1 TPS에서 높은 일치율을 보였다.
특히 PD-L1 TPS의 일치율은 단백질 발현율이 1~49% 사이인 NSCLC 환자에서 더욱 높았다.
PD-L1 TPS가 1~49%인 환자군에서 전문의·AI간 일치율은 94%인 반면, TPS ≥50%, TPS <1% 환자군에서 일치율은 각각 84%, 44%였다.
이 연구는 대규모 독립된 환자 코호트를 통해 베이스라인에서 데이터를 수집하고 성능을 검증했다는데 있어 의의가 있다.
한편 최근 발표된 PD-L1 발현율에 대한 베이지안 메타분석 결과 논문에 따르면, PD-L1 발현율(TPS)이 1% 이상인 NSCLC 환자 비율은 85.3%로 나타났다.
구체적으론 NSCLC 환자 58.3%는 PD-L1 TPS가 49% ≥ 1% 였고, 환자 27.0%는 TPS가 ≥ 50% 이상이었다. 이 논문은 지난 2월 네이처 자매지 사이언티픽 리포트에 게재됐다.
NSCLC 대다수가 PD-L1 발현율(50% 기준)에 따라 면역항암제 단독요법 또는 면역항암제+항암화학요법 병용을 선택해야 하는 만큼, 루닛 스코프 PD-L1의 활용도는 더욱 올라갈 수 있다.
 카카오채널추가
카카오채널추가


















독자의견
작성자 비밀번호
0/200